| Найти: | на: |
МЧС РОССИИ
АКАДЕМИЯ ГОСУДАРСТВЕННОЙ ПРОТИВОПОЖАРНОЙ
СЛУЖБЫ
УТВЕРЖДАЮ
Начальник кафедры
2006i
Фондовая лекция по дисциплине
«Физико-химические основы развития и тушения пожаров» ТЕМА: НЕЙТРАЛЬНЫЕ ГАЗЫ И ХИМИЧЕСКИАКТИВНЫЕ ИНГИБИТОРЫ
Специальность 330400 «Пожарная безопасность»
Рассмотрена и одобрена
на заседании методической секции
протокол № от « »___________ 2006 i
МОСКВА 2006 г.
Негорючие газы и химически активные ингибиторы
Негорючие газы и химически активные ингибиторы относятся к веществам объемного действия. И те, и другие вводят непосредственно в объем смеси горючего газа с окислителем для предотвращения ее воспламенения (взрыва) или в объем зоны горения для тушения пламени. Предотвращение взрыва парогазовых смесей путем введения инертных или химически активных газообразных веществ называется флегматизацией. По механизму действия эти вещества, как следует уже из их названия, существенно различаются. Рассмотрим более подробно механизмы действия, свойства, области и особенности применения и тех и других.
/. Негорючие газы.
Из курса теории горения известно, что в химическую реакцию вступают лишь те молекулы горючего и окислителя, энергия которых в момент соударения превышает энергетический барьер. Выделяемое при этом тепло передается соседним молекулам, увеличивая их энергию. Если она превышает энергию активации, эти молекулы также реагируют с образованием продуктов горения и выделением тепла, продолжая тем самым цепь последовательных превращений горючего и окислителя в продукты горения. Чем больше соударений активных реагирующих молекул, тем больше интенсивность тепловыделения и, соответственно, выше скорость химической реакции. Распространение пламени от источника зажигания по газовой смеси становится возможным при достижении скорости реакции некоторого минимального значения.
В газообразной смеси горючего с окислителем возможны три вида соударений молекул: горючее-горючее, окислитель-окислитель и горючее-окислитель. Очевидно, что эффективными, т.е. приводящими к распространению реакции, являются соударения только последнего вида. Изменение соотношения компонентов приводит к изменению числа эффективных соударений и, как следствие, скорости химической реакции. При снижении скорости реакции до определенного предела интенсивность тепловыделения становится недостаточной для распространения пламени в смеси.
Поэтому смесь горючих газов или паров с окислителем способна воспламеняться от источника зажигания если концентрация горючего в ней соответствует области воспламенения, т.е. фНКпр< фг <фвкпР- Добавление третьего компонента, не способного вступать в реакцию ни с горючим, ни с окислителем, уменьшает концентрацию молекул обоих в единице объема (ТЛ Фг и фок). В результате этого сокращается число эффективных соударений молекул горючего и окислителя, уменьшается интенсивность выделения тепла внутри смеси q :
?+=2A<p№*p(-Jt) CD
где: QHнизшая теплота сгорания горючего; к0 -предэкспоненциальный множитель; срг и (рок -концентрация горючего и окислителя соответственно; пит — порядок реакции по горючему и окислителю, соответственно; Е - энергия активации; R- универсальная газовая постоянная; Т -температура.
При некоторой концентрации инертного в данных условиях разбавителя (флегматизатора) число эффективных соударений сокращается на столько, что выделяемого тепла становится недостаточно для распространения пламени на весь объем смеси.
Концентрационная область воспламенения при добавлении флегматизатора сужается и при некоторой его концентрации верхний предел становится равным нижнему. Данная концентрация называется минимальной " флегматизирующей фт*(рис. 1).
фг,!
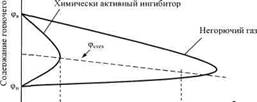
Фт Ф.
Содержание флегматизатора
Рис. 1. Влияние флегматизатора на область воспламенения Таков механизм флегматизирующего действия негорючих газов. К данному виду огнетушащих веществ относятся: диоксид углерода С02, азот N2, водяной пар, гелий Не и аргон Аг. Часто их называют инертными газами, что не совсем корректно. Собственно инертными являются только Не и Аг. Остальные способны вступать в различные химические реакции и являются инертными только по отношению к компонентам конкретной реагирующей смеси.
Эффективность негорючих газов как флегматизаторов должна зависеть от способности их молекул поглощать энергию соударений, т.е. от теплоемкости. Исходя из этого, наибольшей эффективностью (наименьшей фт) должен обладать гелий. Однако, это не так. Из данных, приведенных в табл. 1, следует, что самым эффективным среди этих флегматизаторов является наименее теплоемкий С02.
Дело в том, что скорость распространения пламени по перемешанной смеси в присутствии инертных флегматизаторов зависит от интенсив-ности передачи тепла из зоны реакции в свежую горючую смесь"челПшже теплопроводность смеси, тем меньше скорость распространения пламени. Поэтому флегматизирующая способность негорючих газов определяется соотношением теплоемкости и теплопроводности - с/к (см. табл. 1). Значения фт для разных горючих веществ отличаются. Этим объясняется довольно значительный интервал флегматизирующих концентраций у каждого негорючего газа.
Таблица 1
*При 100°С.
Примечание. М- молярная масса, ср - удельная теплоемкость при 298К, X - коэффициент теплопроводности, <рт - минимальная флегматизирующая концентрация.
Минимальную флегматизирующую концентрацию экспериментально находят путем определения концентрационных пределов распространения пламени по паро- или газовоздушным смесям в присутствии флегматизатора - негорючего газа или химически активного ингибитора. При этом температура смеси, естественно, должна быть такой, чтобы все компоненты находились в газообразном состоянии. По результатам опытов строят график, показанный на рис. 1. За минимальную флегматизирующую принимается концентрация исследуемой добавки, соответствующая пику кривой.
При использование! негорючих газов в качестве огнетушащих веществ, для тушения пожаров, т.е. для прекращения уже начавшегося процесса горения, они поступают в зону горения извне, в смеси с окислителем. Концентрация горючего и окислителя в зоне протекающей реакции уменьшается, что приводит к снижению интенсивности тепловыделения q и, соответственно, температуры пламени. Горение прекращается в тот момент, когда температура пламени снижается до температуры потухания.
Очевидно, что огнетушащая концентрация газа отличается от минимальной флегматизирующей. Наименьшая концентрация газа, при которой прекращается диффузионное пламенное горение, называется ^минимальной; огнетушащей. Для ее экспериментального определения используют метод
диффузионной горелки. Его достоинства и недостатки приведены в монографии [1].
Сущность данного метода заключается в нахождении наименьшего содержания газообразного огнетушащего вещества в потоке воздуха, при котором прекращается горение жидкости. Схема экспериментальной установки показана на рис 2.
ой огнетушащей концентрации газовых составов: 1 - стеклянная труба; 2 - чашечная горелка; 3 - стеклянный бой; 4 - основание; 5 - расширительная емкость; 6 - подъемный столик; 7 - колпак; 8 - трехходовой вентиль; 9 - газовый расходомер; 10 - воздушный расходомер; 11 - воздуходувка.
Значения минимальной огнетушащей концентрации, полученные данным методом, используются в качестве нормативной концентрации при проектировании автоматических установок газового пожаротушения, а также при контроле качества газовых огнетушащих составов.
нии) реакции горения путем нейтрализации промежуточных продуктов. Дело в том, что реакция горения является многостадийной. Сначала образуются промежуточные продукты разложения горючего, затем продукты неполного окисления, потом в результате взаимодействий этих промежуточных продуктов между собой и с горючим или окислителем образуются конечные продукты реакции. Причем каждая последующая стадия может начаться при взаимодействии не любых промежуточных продуктов, а лишь химически активных комплексов - радикалов.
Так, горение органических соединений протекает в две стадии. Сначала исходное горючее, окисляется до СО и Н20, на второй стадии оксид углерода сгорает до С02. Причем вторая стадия является лимитирующей. На этой стадии, при температурах порядка 1000К, в результате взаимодействия СО с гидроксильной группой ОН образуется конечный продукт С02 и активный центр - радикал Н:
ОН + СО -> С02 + Н
Радикал Н реагирует с 02 и образуется два активных центра - радикалы ОН и О:
Н + 02 -> ОН + 6
В результате реакций с участием этих радикалов появляется один конечный продукт - Н20 и уже три активных центра и т.д.:
ОН + Н2->Н20 + Н 6 + Н2 ->ОН + Н
6+н2о ->6н+6н
Т.е. реакция представляет собой разветвленный цепной процесс. Если в зону его протекания ввести дополнительные вещества, нейтрализующие активные центры, которые участвуют в продолжении цепей (Н, ОН, Н02) будет происходить обрыв этих цепей, торможение реакции, уменьшение интенсивности тепловыделения и, в конечном счете, прекращение горения. Причем горение прекращается при гораздо более высокой температуре, чем в случае применения негорючих газов (рис. 3).
|
Наибольшее применение негорючие газы находят в качестве огнетушащих веществ - для прекращения горения. Чаще всего используется диоксид углерода как самый эффективный и дешевый.
2. Химически активные ингибиторы.
В отличие от негорючих газов химически активные ингибиторы (в дальнейшем ХАИ) практически не влияют на число активных соударений молекул и окислителя. Их огнетушащие концентрации не превышают 10%об. Механизм их действия заключается в торможении (ингибирова-
0 10 20 30 40 50 0 12 3 4 5 6
Содержание азота, %об Содержание хладона 13В1, %об
Рис. 3. Зависимость адиабатической температуры горения стехиометриче-ской метано-воздушной смеси от содержания флегматизатора [2].
Пунктиром обозначена минимальная флегматизируюгцая концентрация.
Такими свойствами обладают некоторые производные предельных углеводородов, в которых атомы водорода частично или полностью замещены на атомы галогенов. Например:
CF3Br + H ->CF3+HBr; HBr + OH -^H20 + Br; Вг + Н02 ->НВг+02.
Техническое название этих веществ - хладоны. При нормальных условиях одни из них находятся в газообразном состоянии, другие — в жидком. Маркируются хладоны двух- и трехзначными цифрами. Расшифровка производится справа - налево. Последняя цифра обозначает количество в молекуле атомов фтора, предпоследняя - атомов водорода, увеличенное на 1 (т.е. Н + 1), первая - атомов углерода, уменьшенное на 1 (т.е. С - 1). В маркировку бромсодержащих хладонов, добавлена буква "В" и цифра, означающая количество атомов брома. В данной системе маркировки не указываются напрямую атомы хлора. Предполагается, что хлор занимает оставшиеся свободные связи. Примеры:
13Bl-CF3Br,
здесь Вг = 1, F = 3; Н + 1 = 1, следовательно Н = 1-1=0;С—1 = 0, откуда С = 0
+ 1 = 1;
114B2-C2F4Br2,
здесь Вг = 2, F = 4, Н = 1 - 1 = О, С - 1 = 1, откуда С = 1 + 1 = 2;
12Bl-CF2ClBr,
здесь Вг = 1, F = 2; Н + 1 = 1, следовательно Н = 1-1=0;С-1 = 0, откуда С = 0
+ 1 = 1, оставшаяся у углерода одна свободная связь занята С1;
318Ц - C4Fg - перфторциклобутан.
В последнем случае буква "Ц" обозначает, что данное вещество имеет циклическое строение.
На западе хладоны подразделяют по областям применения. Хладоны, применяемые для производства аэрозолей, называют пропелентами, хла-доагенты для холодильных установок - рефрежентами, а хладоны, используемые для пожарной защиты, - талонами. Для талонов используется более простое обозначение четырехзначными цифрами.
Проведенные в 1947 г. в США масштабные исследования огнетуша-щей способности и токсичности различных галогенуглеводородов показа-
ли, что их огнетушащая способность связана со строением молекулы и возрастает в ряду F-, С1-, Вг- замещенных углеводородов. Энергия химической связи уменьшается в ряду С - F > С - С1 > С - Вг. Поэтому бромсо-держащие углеводороды подвергаются термической диссоциации при более низких температурах и оказывают более сильное ингибирующее действие на реакцию горения. В связи с этим можно предположить, что еще большей огнетушащей способностью будут обладать иодсодержащие углеводороды.
Из 60 исследованных соединений в результате испытаний было отобрано четыре хладона: 12В2 (CF2Br2), 12B1 (CF2ClBr), 13B1 (CF3Br) и 114В2 (C2F4Br2). Первый хладон обладал наибольшей огнетушащей способностью, однако он был самым токсичным. Поэтому дальнейшее применение в качестве огнетушащих веществ нашли хладоны 12В1, 13В1 и 114В2. Некоторые свойства этих хладонов, а также, для сравнения, свойства диоксида углерода приведены в табл. 2.
Таблица 2
Хладон |
Температура кипения, "С |
Минимальная флегм атизирующая концентрация, % об |
Токсичность (LD50), % об |
12В1 13В1 114В2 |
-4 -58 47 |
3,8 3,5 2,5 |
13 80 10 |
со2 |
-76 |
28 |
9 |
Примечание. Токсичность LD50 - концентрация вещества в воздухе, вызывающая гибель половины подопытных животных в стандартных условиях испытаний.
Как видно из табл. 2, в отличие от С02, огнетушащие концентрации этих хладонов в несколько раз меньше концентраций, при которых возможен летальный исход. Это позволило применять хладоновые установки пожаротушения в частности в тех случаях, когда затруднена или невозможна эвакуация людей. Это танки, самолеты, подводные лодки, командные пункты и т.п. Наибольшее применение для этих целей в США получил хладон 13В1, в СССР - хладон 114В2 так как его производство обходилось почти в три раза дешевле. Хладон 12В1 использовался, в основном, в переносных огнетушителях, так как он имел небольшое давление паров и в связи с этим Ш требовал прочных емкостей для хранения.
Широкое применение хладонов для целей пожаровзрывозащиты началось с середины 60-х г.г. XX века. Системами хладонового пожаротушения наряду с военными объектами оборудовались помещения вычислительных центров, музейные хранилища, газокомпрессорные станции, объекты энергетики и т.д. Однако в 70-х — начале 80-х г.г. было обнаружено, что толщина озонового слоя, который защищает все живое на земле от же-
сткого ультрафиолетового излучения, стала резко уменьшаться, и что одной из основных причин этого является выброс в атмосферу галогенугле-водородов.
Под действием ультрафиолетового излучения их молекулы диссоциируют с образованием атомов галогенов. Например:
CF2Cl2+hv-»CF2Cl + Cl;
CF2Br + hv->CF, +Br. Образовавшиеся атомы галогенов, взаимодействуя с озоном, уничтожают его:
Cl + 03->C10 + 02; Вг + 03-»ВЮ + 02. Озоновую активность галогенуглеводородов характеризуют озоно-разрушающим потенциалом (ОРП). За единицу принят ОРП хладона 11 (CC13F). К озонобезопасным относят хладоны с ОРП < 0,05. Оказалось, что самыми озоноопасными являются хлор- и бромсодержащие хладоны 12В1, 13В1 и 114В2. Значения их ОРП приведены в табл. 3. Таблица 3
Хладон |
Химическая |
ОРП |
Плотность при 20 "С, кг/м3 |
12В1 13В1 114В2 |
CF2ClBr CF3Br C2F4Br2 |
3,0 10,0 6,0 |
6,86 10,04 9,32* |
*В газообразном состоянии.
Озоновый слой, как известно, располагается на высоте от 7 до 20 км. Над Антарктидой расстояние до него от поверхности земли 7-9 км, в районе экватора 15 - 20 км. Плотность хладонов в несколько раз больше плотности воздуха и нет четких доказательств того, что они способны достигать столь большой высоты. Тем не менее, в соответствии с международными соглашениями, производство озоноразрушающих хладонов, в том числе 12В1, 13В1 и 114В2, прекращено во всем мире.
Химической промышленностью выпускаются озонобезопасные хладоны. К озонобезопасным ХАИ относят также гексафторид серы SFe - техническое название "элегаз". Однако по огнетушащей способности все они уступают хладонам 12В1, 13В1 и 114В2. Характеристики некоторых озо-нобезопасных хладонов, допущенных к применению в нашей стране, приведены в табл. 4.
Таблица 4
Хладон |
ОРП, % об |
Концентрация* , % об |
Ю$о, |
% об |
|
минимальная флегматизирующая |
нормативная* |
||||
125 (C2F5H) |
0 |
9,1 |
9,8 |
65 |
218 (C3F8) |
0 |
6,7 |
7,2 |
80 |
227 (C3F7H) |
0 |
5,8 |
7,2 |
80 |
13В1 (CF3B1-) |
10 |
3,5 |
- |
80 |
со2 |
0 |
28 |
35 |
9 |
* Для н-гептана.
*2ПоНПБ88 2001.
Самым близким к хладонам 13В1 и 114В2 по огнетушащей способности является хладон 1311 — CF3J. Его огнетушащая концентрация составляет 2,8 % об, а ОРП равен нулю. Токсичность его также не высокая. Однако он имеет слишком большую стоимость для широкого применения.
Огнетушащая эффективность хладонов, как уже говорилось, определяется их способностью участвовать в химических реакциях, протекающих в зоне горения. Одним из продуктов этих реакций, как оказалось, является фтористый водород — HF. Причем, его выделяется больше при тушении пламени жидкости (очаг класса В), чем твердых горючих материалов (очаг класса А). По-видимому, это объясняется более высокой температурой горения жидкостей. Фтористый водород представляет собой газообразное вещество с резким запахом, высокотоксичное, с сильнораздражающим действием на ткани организма. Исследования ВНИИПО показали, что при одинаковых условиях озонобезопасные хладоны 125, 227еа, 218, 318Ц выделяют в 5 -10 раз больше HF, чем хладон 13В1 и в замкнутом объеме создают среду опасную для жизни и здоровья человека. Элегаз кроме HF выделяет S02, концентрация которого, достигает летальных значений.
Поэтому перечисленные хладоны нельзя использовать в помещениях, из которых невозможна или затруднена эвакуация людей.
Параметры тушения негорючими газами и ХАИ,
Определим интенсивность подачи J диоксида углерода, требуемую для прекращения горения локального розлива бензина площадью около 2 м . Приведенную массовую скорость выгорания vM' бензина примем равной 0,05 кг/(м 'С)| низшую теплоту сгорания 43576 кДж/кг.
Количество тепла, которое необходимо отвести от зоны горения для снижения температуры пламени от Тг до ТПОт> найдем из уравнения теплового баланса пламени:
<7п = ?зг + 9луч, ()
здесь: </., приведенная интенсивность тепловыделения в зоне горения, кДж/(см'); (/,, интенсивность накопления тепла в зоне горения, кДж/(см2); (/.„¦г - интенсивность теплопотерь излучением, кДж/(с-м ).
Интенсивность излучения пламенем бензина в окружающую среду достигает 40% от теплоты сгорания. Поэтому можем принять qJiy4= 0,4 q„. Тогда в зоне горения остается q3r- q„ - 0,4 qn= q„(l- 0,4), кВт/м . Если отобрать все это тепло, температура в зоне горения понизится до нуля. Количество тепла, которое необходимо отвести от пламени пропорционально разности Тг - Тпот. Введем коэффициент снижения температуры к = (Тг-Тпот)/Тг. Т.о. требуемая, в данном случае, интенсивность теплоотвода qrTpe равна <7П(1 - 0,4)к.
При горении розлива бензина площадью около 2 м2 (диаметр примерно 1,6 м) температуру пламени Тг можно принять 1250°С, действительную температуру потухания Тпот - 1000°С. Тогда к = (1250 — 1000)/1250 = 0,2. Приведенная теплота пожара (интенсивность тепловыделения) qn= fivJQH. Т.к. теоретический объем воздуха, требуемый^ш сгорания бензина 11,6>10 м3/кг, принимаем коэффициент полноты сгорания Р = 0,8. Тогда q„ = 0,8-0,05-43576 = 1743,0 кВт/м2. Отсюда: дтреб = 0,6-0,2-1743 = 209,20 кВт/м .
Количество тепла, которое отбирает С02, нагреваясь от начальной температуры Т0 до температуры потухания пропорционально удельной теплоемкости ср: Q= 7яср(Тпот-Т0). В данном интервале температур средняя удельная теплоемкость СОг равна 1,03 кДж/(кгтрад). Теплопоглощающая способность 1 кг СОг составляет: Q = 1-1,03(1000 - 20) » 980 кДж/кг.
Требуемая интенсивность подачи /реб * qrpe6/Q= 209,2/980 = 0,21 кг/(с-м2).
Рассмотрим процесс тушения пожара негорючим газом или химически активным ингибитором в негерметичном помещении на упрощенной модели. Допустим, что газообразное огнетушащее вещество, подаваемое установкой пожаротушения, мгновенно распространяется по всему объему и его концентрация в любой точке помещения в каждый момент времени равна среднеобъемной. Тогда, концентрация газа в потоке продуктов сгорания, удаляющихся из помещения вследствие газообмена, также будет равна среднеобъемной. Также допустим, что расходы огнйгушащеш газа и продуктов сгорания во .время тушения остаются постоянными. Тушение наступает, когда концентрация газа (ф) в помещении становится раним ог-нетушащей (ф0™)- Вместо объемной концентрации ф будем использовать объемную долю а = ф/100.
Составим материальный баланс процесса заполнения помещения газом:
qmdT=VnoMda+a4lmcJ':'0
где: дш - расход негорючего газа, м /о; qm- расход продуктов горения, м /о;
- объем помещения, м ;т - время, с.
da |
Разделив переменные, получим:
dr= К.
o,„-qа
V |
Учитывая, что т изменяется от 0 до времени тушения тт, а содержание газа в объеме помещения от 0 до огнетушащего аогн, проинтегрируем данное выражение и, подставив значения переменных на пределах интегрирования, найдем тт:
О
q„ Q —Q а
~пг ?нг "пг о
Разложим логарифм в степенной ряд по формуле In x= |(;с-1)/(л:+1)|. Используя первый член этого ряда, получим выражение, более удобное для анализа:
2V а
тт =------- пом огн , с ( )
2q, — e„„a„
" нг " пг огн
Анализ данной формулы показывает, что при тушении пожара секундный расход негорючего газа не может быть меньше некоторой критической величины. Если знаменатель дроби равен нулю, то тт —* со и тушение не наступает. Такой секундный расход называется критическим. Из формулы (..) следует, что его величина составляет:
кр Яшг' |
О |
1 з,
Т^пгОогн.М /С
Формула (..) описывает кривую тушения негорючим газом, характерный вид которой показан на рис. 4.
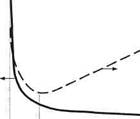
>
Расход газа, м3/с
9кг <7нг
Рис. 4. Зависимость времени тушения и удельного расхода негорючего газа от его секундного расхода.
Оптимальный секундный расход газа, соответствующий минимальным затратам огнетушащего вещества можно оценить следующим образом. Удельный расход ra3agHr равен произведению:
